阿伏加德罗常数(阿伏伽德罗常数的由来与考点)
高中化学和物理中,阿伏伽德罗常数都是一个重要的知识点,在化学中我们经常会用到,那么什么是阿伏伽德罗常数,它是怎么被发现的呢?今天化学姐就来给大家讲一讲
什么是阿伏伽德罗常数
在物理学和化学中,阿伏伽德罗常数(符号:NA或L)的定义是一个比值,是一个样本中所含的基本单元数(一般为原子或分子)N,与它所含的物质的量n(单位为摩尔)间的比值,公式为NA=N/n。因此,它是联系一种粒子的摩尔质量(即1摩尔时的质量),及其质量间的比例常数。阿伏伽德罗常数用于代表1摩尔物质所含的基本单元(如分子或原子)之数量,而它的数值为:
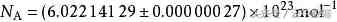
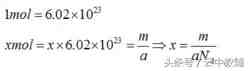
在一般计算时,常取6.021023或6.0221023为近似值。
阿伏伽德罗常数的由来

那么阿伏伽德罗常数到底是怎么的出来的呢?是不是由阿伏伽德罗测出来的?这里要明白两个问题:
阿伏伽德罗常数并非阿伏伽德罗所测定:
1811年,阿伏伽德罗提出了分子学说,这一学说被长期摈弃,冷落了50年之久。后来人们为了纪念阿伏伽德罗,把1摩尔任何物质中含有的微粒数,称之为阿伏伽德罗常数。
2.关于阿伏伽德罗常数的测定:
阿伏伽德罗虽然提出了著名的分子假说,但他本人对于一定容积内的气体分子究竟有多少并不了解,只知道这是一个很大的数目.最早得出这个数目的是奥地利物理学家洛施米特。
(1)奥地利化学及物理学家约翰约瑟夫洛施米特于1865年根据气体运动论计算出某固定体积气体内所含的分子数,成功估计出空气中分子的平均直径(空气分子的大小)。
同年在科学杂志上发表了一篇测定分子大小的论文摘要,这篇文摘中第一次出现了N值,等于866x1012个分子/mm3.这就是阿伏伽德罗常数的最早值,又称洛施密特常数。
这么巨大的一个数字是否真实呢? 它究竟是一个凭空想象出来的数字,还是一个实际存在的数字呢? 伴随着对阿伏伽德罗常数的看法的是对分子、原子实际存在的怀疑.19 世纪后期,以奥斯特瓦尔德,为代表的一些权威科学家表示了对分子运动论的强烈怀疑。

(2)1905年,爱因斯坦发表了两篇研究悬浮粒子运动的论文,4月写的一篇是他向苏黎世大学申请的博士论文,题为《分子大小的新测定法》,5 月写的一篇题为《热的分子运动、论所要求的静液体中悬浮拉子的运动》。在第一篇论文中提出了测定分子大小和阿伏伽德罗常数的新方法。即液体中分子大小的测定。也证实了阿伏伽德罗常数的真实性。
(3)1908年,法国物理学家让.佩兰证实了爱因斯坦的理论预测(用实验成功地解决了对热理论关系重大的问题)。
佩兰利用离心分离法,花了数月的时间提取了一定半径的树脂微拉和藤黄微粒,配制五种不同半径的藤黄乳状液和一种树脂乳状液,用超显微镜观察计算不同高度处微小颗粒,其总数逾万。将结果代入高度分布公式,求得阿伏伽德罗常数为5-8x 1023
1926年佩兰荣获诺贝尔物理学奖。授奖人C.W.osen教授说: “佩兰的研究结束了关于分子是否其实存在的长期事论。”
让佩兰最早提出阿伏伽德罗数(N)这样一个名字,来代表一克分子的氧的分子数(根据当时的定义,即32克整的氧),而这个词至今仍被广泛使用,尤其是入门, 1971年摩尔成为国际单位制基本单位之百思特网后,课本改用阿伏伽德罗常量(NA)这个名字。
高考化学有关阿伏伽德罗常数考点
那么明白了阿伏伽德罗常数的产生,我们在后面的学习中肯定会对它印象更加深刻,那么这里化学姐就给大家说说有关阿伏伽德罗常数在高考化学中的几个考点:
1、同位素的概念及原子的构成:给出一定质量、一定物质的量或一定体积的物质,计算该物质中所含分子数、原子数、质子数、电子数等。
2、分子组成:如18O2中质子、中子、电子及其摩尔质量。
3、物质结构中化学键及共用电子对的数目:如CnH2n+2共用电子对数为:3n+1。
4、取代基及其原子团:如 —CH3中的电子、质子等。
5、物质状态问题:如水在标准状态下为液态;SO3在标准状态下为固态,常温常压下为液态;碳原子大于4的烃在标准状态下不是气态。
6、同素异形体及最简式相同的物质:如等质量时①金刚石与石墨②氧气和臭氧③C2H2 和C6H6④NO2和N2O4等组合原子数相同而分子数不同。
7、氧化还原反应:较复杂百思特网的化学反应中,转移电子数的计算:如过氧化钠和水反应、氯气和氢氧化钠反应、溶液电解计算等。
8、某些离子或原子团在水溶液中能发生水解,使其数目减少。
9、弱电解质的部分电离。
10、关于阿伏伽德罗定律的关键:四个相同指同温同压同体积的任何气体含有相同的气体分子数(或相同的物质的量)。用到22.4 Lmol-1 时,必须注意气体是否处于标准状况。
11、涉及化学反应的发生及反应进行情况的计算:要注意给出的物质彼此间是否会发生一些反应、反应能否完全进行(可逆反应)、产生的气体能否从溶液中逸出等问题。
易错点要特别注意
1.条件:考查气体时经常给的条件为非标准状况,如常温常压下等。
2.物质状态:考查气体摩尔体积时,常用在标准状况下为非气态的物质来迷惑考生,如H2O、SO3、己烷、辛烷、CHCl3等。
3.物质结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及惰性气体He等单原子分子,Cl2等双原子分子,以及O3、P4等。
4.电离水解:考查电解质溶液中粒子数目或浓度时常设置弱电百思特网解质的电离、盐类水解方面的陷阱。
5.化学键数目:如SiO2、Si、CH4、P4等
6.摩尔质量:特殊物质如D2O等。
