甲基化修饰(蛋白质的甲基化修饰)
蛋白质的甲基化(methylation)是指将甲基酶促转移到蛋白质的某个残基上,通常是赖氨酸或精氨酸,也包括组氨酸、半胱氨酸和天冬酰胺等。蛋白质的甲基化是一种普遍的修饰,在大鼠肝细胞核的总蛋白提取物中,大约2%的精氨酸残基是二甲基化的。
蛋白质甲基化经常与乙酰化并列,因为它们都是常见的表观遗传修饰,经常发生在组蛋白上。不过从化学反应的角度来看,乙酰化可以算作一种短链脂酰化修饰,这里主要讨论甲基化方面的问题。
蛋白质的甲基化供体是S-腺苷甲硫氨酸(SAM),受体通常是赖氨酸的-氨基和精氨酸的胍基。另外在组氨酸的咪唑基、谷氨酰胺和天冬酰胺的酰胺基、半胱氨酸的巯基、半胱氨酸的羧基、谷氨酸和天冬氨酸的侧链羧基都可以发生甲基化反应。
半胱氨酸羧基甲基化的例子我们在讲蛋白质异戊二烯化的时候提到过,一些具有CAAX序列的蛋白质添加异戊二烯基之后,会将AAX切除,然后半胱氨酸的羧酸被甲基化,形成甲酯。
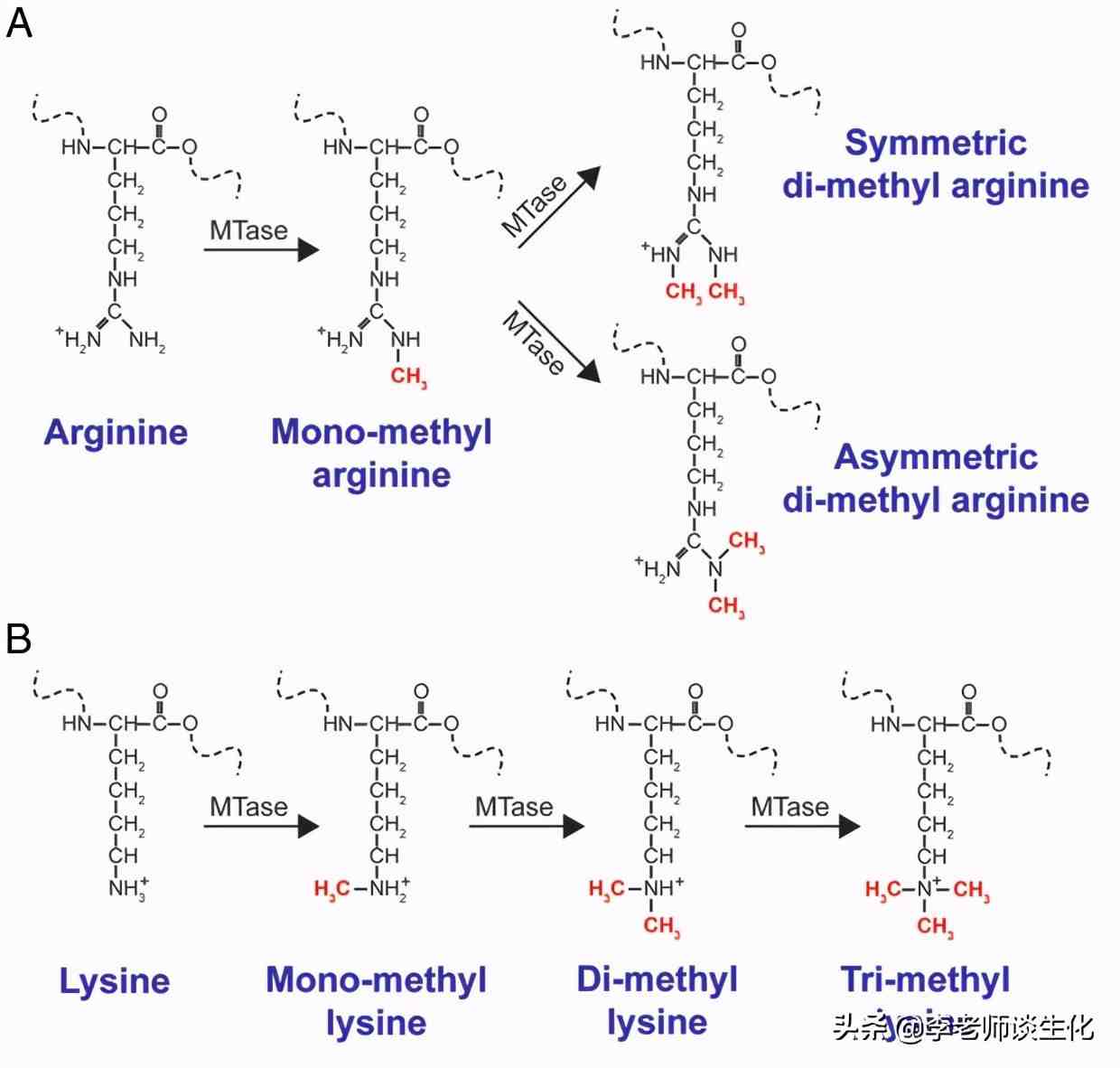
精氨酸和赖氨酸的甲基化。Mol Endocrinol. 2009 Sep; 23(9): 1323–1334.
赖氨酸残基可以发生单、双或三甲基化修饰。精氨酸可以单甲基化或二甲基化,后者可以是不对称的(两个甲基都连接到在精氨酸侧链末端的同一个N原子上)或对称的(两个末端N原子上各有一个甲基),具体取决于甲基转移酶。人类表达27种赖氨酸甲基转移酶(KMT)和9种蛋白质精氨酸甲基转移酶(PRMT)。
赖氨酸甲基化最初被认为是永久性共价标记,但后来发现赖氨酸甲基化可以是瞬时的,可以通过脱甲基反应来动态调节。许多酶催化赖氨酸脱甲基反应,其中最大的一类是含有Jumonji C(JmjC)域的脱甲基酶,是2-氧戊二酸和Fe2+依赖性双加氧酶。
作为经典的表观遗传修饰,核小体中组蛋白的甲基化是染色质结构和基因转录活性的重要调节剂。在组蛋白H3和H4上至少存在五个可以被甲基化的精氨酸残基(H3R2,H3R8,H3R17,H3R26和H4R3)和六个赖氨酸残基(H3K4,H3K9,H3K27,H3K36,H3K79和H4K20)。不同位点的甲基化可能对转录产生正反不同的作用。
除组蛋白外,很多种蛋白都能发生甲基化。蛋白质甲基化可能影响蛋白质-蛋白质相互作用,蛋白质-DNA或蛋白质-RNA相互作用,蛋白质稳定性,亚细胞定位或酶活性。许多转录因子的甲基化修饰可以影响基因表达。
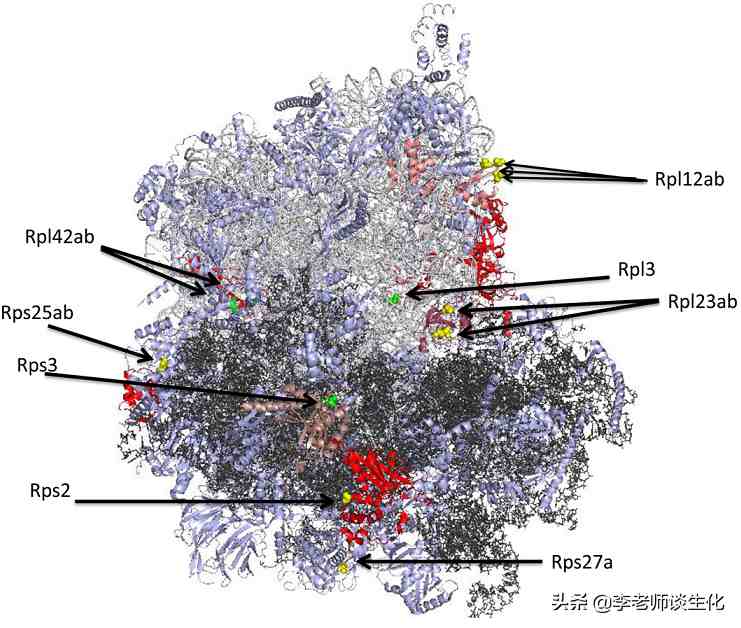
酵母核糖体蛋白表面和内部的甲基化位点。Trends Biochem Sci. 2013 May; 38(5): 243–252.
与乙酰化和磷酸化不同,甲基化不会影响残基的总电荷。但甲基的存在仍然会影响其性质。一个典型的例子是精氨酸甲基化影响相分离过程。
精氨酸侧链的正电荷可以与芳香环上的电子相互吸引,属于阳离子-相互作用的一种。这种作用力在蛋白质折叠、蛋白质与其它分子相互作用时经常发挥重要作用,比如参与液-液相分离(LLPS)过程。
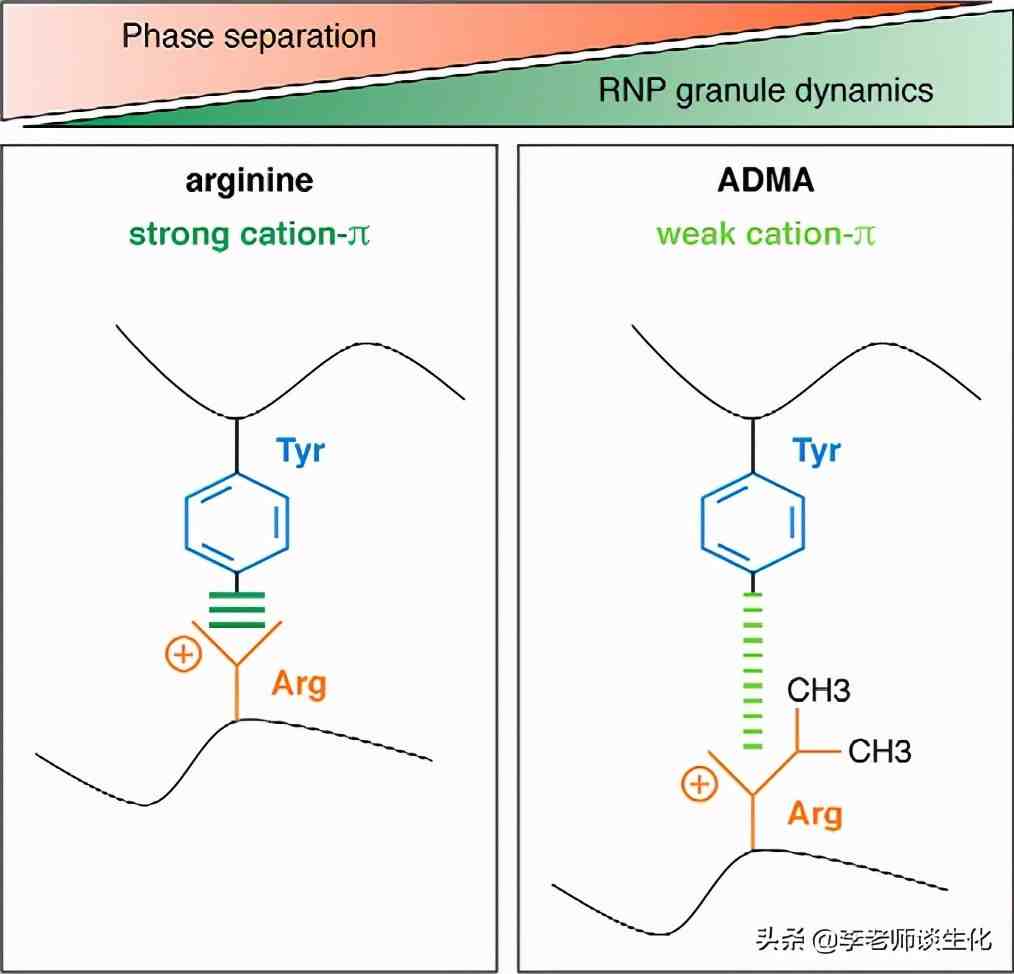
精氨酸甲基化减弱阳离子-相互作用。J Biol Chem. 2019 May 3; 294(18): 7137-7150.
生物大分子通过相分离形成凝聚物(condensate),也称为液滴(百思特网droplet)或无膜细胞器(membrane-less organelles,MLO)。这种凝聚物是亚稳态的,可以硬化成粘性液体、凝胶(gel)、甚至是固体的淀粉样物质(amyloid)。这一过程可以与多种生理病理现象相关,如染色质高级结构、基因表达、核糖体形成、DNA损伤应答以及神经退行性疾病等。
FUS(fused in sarcoma)是一个多功能的DNA/RNA结合蛋白,在RNA的转录、剪接、转运、翻译等过程中发挥重要作用。但其功能异常会导致多种神经退行性疾病,称为FUS蛋白病,包括FUS相关的额颞叶脑退行性病变/痴呆(frontotemporal lobar degeneration/dementia, FTLD-FUS)、非肌萎缩侧索硬化症(Amyotrophic Lateral Sclerosis, ALS-FUS)等。
FUS的低复杂度(LC)结构中可以形成反平行-片层结构,这种结构能够稳定其液滴和凝胶状态,从而促进某些相分离过程,如核糖核蛋白(RNP)颗粒的形成。此过程中,精氨酸与酪氨酸之间的阳离子-相互作用是关键驱动力。研究表明,精氨酸的甲基化会削弱这一作用,从而降低LLPS。
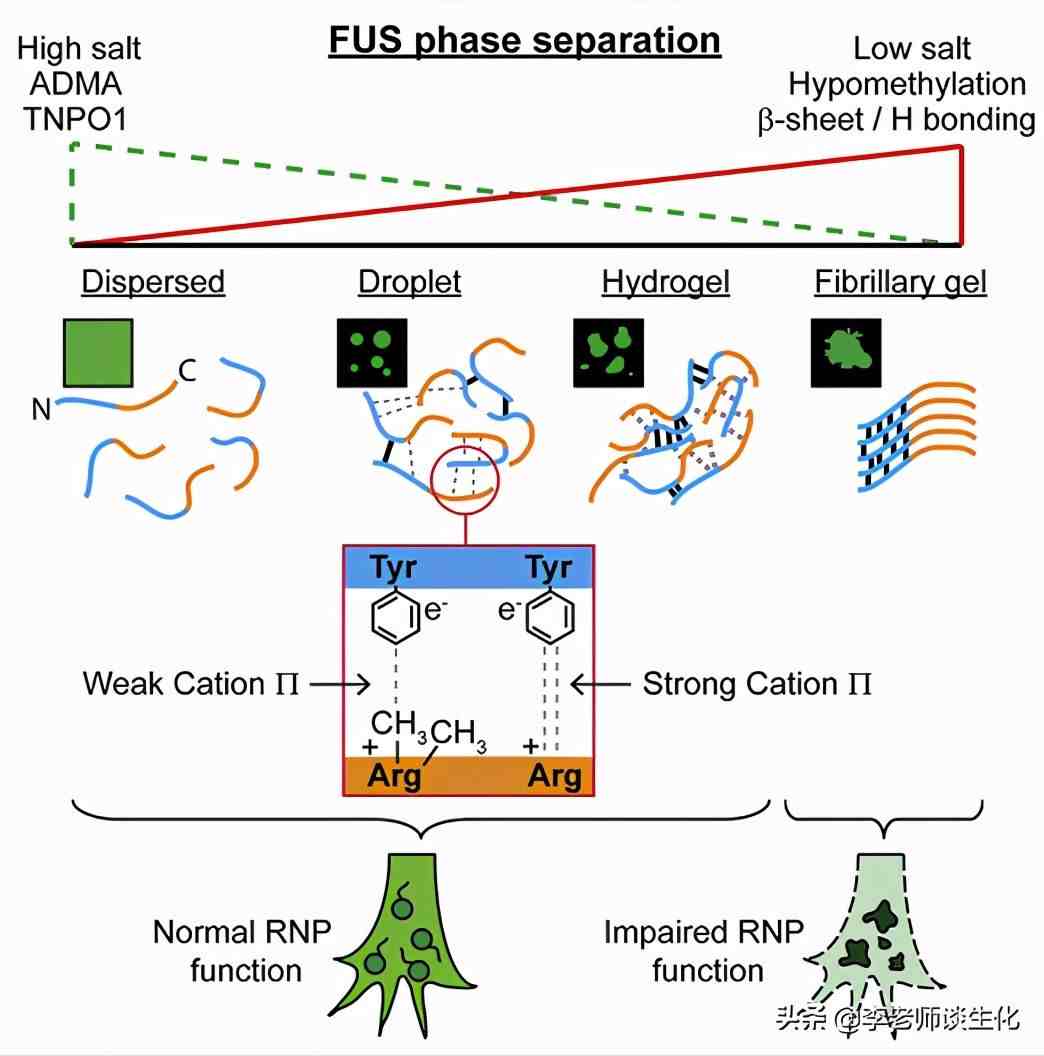
精氨酸甲基化影响FUS相分离。Cell. 2018 Apr 19; 173(3): 720–734.e15.
RNP颗粒参与调节亚细胞部位(如轴突末端和树突)中的局部RNA和蛋白质代谢。这个过程如果出现问题可能引发疾病,如ALS和FTLD等。目前已经发现,甲基化被抑制时会形成低甲基化的FUS(HYPO-FUS),使LLPS增强,形成大量液滴和富含-折叠的水凝胶,促进淀粉样蛋白沉积,最终导致神经退行性疾病。
参考文献:
1. Mario Hofweber, et al. Friend or foe—百思特网Post-translational modifications as regulators of phase separation and RNP granule dynamics. J Biol Chem. 2019 May 3; 294(18): 7137–7150.
2. Steven G. Clarke. Protein methylation at the surface and buried deep: thinking outside the histone box. Trends Biochem Sci. 2013 May; 38(5): 243–252.
3. Seema Qamar, et al. FUS Phase Separation Is Modulated by a Molecular Chaperone and Methylation of Arginine Cation- In百思特网teractions. Cell. 2018 Apr 19; 173(3): 720–734.e15.
4. Susan C. Wu, et al. Minireview: Role of Protein Methylation and Demethylation in Nuclear Hormone Signaling. Mol Endocrinol. 2009 Sep; 23(9): 1323–1334.
5. Young-Ho Lee, et al. Minireview: Protein Arginine Methylation of Nonhistone Proteins in Transcriptional Regulation. Mol Endocrinol. 2009 Apr; 23(4): 425–433.
